1-Butylpyridiniumchlorid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
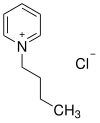
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1-Butylpyridiniumchlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C9H14ClN | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 171,67 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
1-Butylpyridiniumchlorid ist ein organisches Salz. Es liegt als weißer Feststoff vor und findet vor allem in der Synthese von ionischen Flüssigkeiten Anwendung.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Historische Bedeutung kommt dem 1-Butylpyridiniumchlorid vor allem durch seinen Einsatz in ionischen Flüssigkeiten zu. So beschrieb Osteryoung 1978 erstmals ein System aus Aluminiumchlorid und 1-Butylpyridiniumchlorid (AlCl3-BPC).[2] Das so entstehende Haloaluminat gilt als ein erstes Beispiel für eine ionische Flüssigkeit der ersten Generation.[3]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Durch Erhitzen von Pyridin mit 1-Chlorbutan kann 1-Butylpyridiniumchlorid erhalten werden.[4] Eine alternative, aber weniger atomökonomische Alternative stellt eine Zincke-Reaktion dar.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]1-Butylpyridiniumchlorid schmilzt bei 131 °C.[1] Durch Zugabe von Aluminiumchlorid lässt sich der Schmelzpunkt bis auf 40 °C verringern.[6] Verglichen mit anorganischen Aluminiumchloridmischungen besitzt diese Mischung ein kleineres elektrochemisches Fenster, da das Pyridinium reduziert werden kann.[6]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Die US Air Force meldet 1978 das Patent "AlCl3 /1-alkyl pyridinium chloride room temperature electrolytes" an. Ziel war es, Mischungen wie AlCl3-BPC als Elektrolyt in Batterien einzusetzen.[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt 1-n-Butylpyridinium chloride bei Alfa Aesar, abgerufen am 27. November 2021 (Seite nicht mehr abrufbar).
- ↑ R. J. Gale, B. Gilbert, R. A. Osteryoung: Raman spectra of molten aluminum chloride: 1-butylpyridinium chloride systems at ambient temperatures. In: Inorganic Chemistry. Band 17, Nr. 10, 1. Oktober 1978, S. 2728–2729, doi:10.1021/ic50188a008.
- ↑ Michael Freemantle: An Introduction to ionic liquids. RSC Pub, Cambridge, UK 2010, ISBN 978-1-84755-161-0, S. 8–10.
- ↑ Fatima Mirante, Neide Gomes, Marta C. Corvo, Sandra Gago, Salete S. Balula: Polyoxomolybdate based ionic-liquids as active catalysts for oxidative desulfurization of simulated diesel. In: Polyhedron. Band 170, 2019, S. 762–770, doi:10.1016/j.poly.2019.06.019.
- ↑ Sanhu Zhao, Xiaoming Xu, Lu Zheng, Hai Liu: An efficient ultrasonic-assisted synthesis of imidazolium and pyridinium salts based on the Zincke reaction. In: Ultrasonics Sonochemistry. Band 17, Nr. 4, 2010, S. 685–689, doi:10.1016/j.ultsonch.2009.12.019.
- ↑ a b John S. Wilkes: A short history of ionic liquids—from molten salts to neoteric solvents. In: Green Chemistry. Band 4, Nr. 2, 2002, S. 73–80, doi:10.1039/B110838G.
- ↑ Patent US4122245A: AlCl3 /1-alkyl pyridinium chloride room temperature electrolytes. Veröffentlicht am 24. Oktober 1978, Erfinder: John C. Nardi, Charles L. Hussey, Lowell A. King.