Apocarotinoide
Apocarotinoide sind eine Stoffklasse natürlich vorkommender Polyene, bei denen es sich um oxidative Spaltprodukte von Carotinoiden handelt.[1] Die Apocarotinoide zählen zu den Terpenoiden, bei denen die Endgruppe abgespalten und durch eine Carboxy-, Aldehyd- oder Hydroxygruppe ersetzt wird. Werden beide Endgruppen oxidativ gespalten, so handelt es sich um Diapocarotinoide.[2]
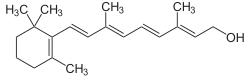
Bekannte Beispiele für Apocarotinoide sind die Vitamin-A-Verbindungen Retinal, Retinol und Retinsäuren[3]
-
Retinal
-
Retinol
-
Retinsäure
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Während Carotinoide ausschließlich in höheren Pflanzen gebildet werden und in deren Blättern, Früchten, Sprossen und Wurzeln vorkommen, kommen Apocarotinoide auch in tierischen Organismen als Metabolite mit der Nahrung aufgenommener Carotinoide vor. Sie finden sich als Chromoproteine im Blutplasma, im Eidotter, in den Federn mancher Vögel wie beispielsweise den Flamingos, in der Haut von Forellen, im Fleisch einiger Fische wie den Lachsen oder Lachsforellen, sowie in den Panzern von Krebsen (Crustaceen).[2]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Apocarotinoide haben verschiedene Funktionen:[3]
- Das C20-Apocarotinoid Retinal spielt eine wichtige Rolle beim Sehvorgang des Auges, insbesondere beim Farbensehen.
- Durch eine asymmetrische Spaltung von Lycopin erhält man das C24-Spaltprodukt Bixin, ein Diapocarotinoid mit einer intensiven orangen bis purpurroten Farbe das als Lebensmittelfarbstoff E 160b[4] Verwendung findet.
- Die Farbe und das Aroma von Safran entsteht vermutlich durch die enzymatische Spaltung von Zeaxanthin. Dabei entsteht aus der C40-Verbindung die farbgebende C20-Dicarbonsäure Crocetin und das C10-Spaltprodukt Safranal.

der 7–8- und 7'–8'-Doppelbindungen
- Durch die Spaltung von Carotinoiden an den 9,10- und 9',10'-Doppelbindungen erhält man C13-Apocarotinoide, die zu den Duft- und Aromastoffen zählen. Es sind eine Vielzahl von Verbindungen mit einem Jonon-Grundgerüst bekannt, die meist blumige bis fruchtige Duftnoten aufweisen. So wird beispielsweise der Duft vieler Rosen durch Damascenone bestimmt.

der 9–10- und 9'–10'-Doppelbindungen
- Das C15-Apocarotinoid Abscisinsäure ist ein Signalstoff, der zu den Pflanzenhormonen zählt.

der 11–12-Doppelbindung von Violaxanthin[5]
Biosynthese
[Bearbeiten | Quelltext bearbeiten]Die Biosynthese der Apocarotinoide erfolgt durch carotinoidspaltende Enzyme, den Oxygenasen. Bei Menschen und Tieren erfolgt die Spaltung überwiegend mittig bei der Doppelbindung in 15–15'-Position, während die pflanzlichen Enzyme außermittig spalten. Die Carotinoidoxygenasen gehören zu den Nicht-Häm-Eisenenzymen und benötigen O2 sowie Fe2+ als Cofaktoren.[3]

beispielsweise β-Carotin Oxigenase (BCO) aus der Fruchtfliege und carotinoidspaltende Monooxigenase 1 (CMO1)
aus Maus und Mensch.
Verschiedene pflanzliche Carotinoidoxygenasen (Corotenoid Cleavage Dioxygenases, CCD) spalten außermittig
die Doppelbindungen in der 5–6-, 5'–6'-, 7–8-, 7'–8'-, 9–10-, 9'–10'-, 11–12- oder 13–14-Position.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Shoib Ahmad Baba, Nasheeman Ashraf: Apocarotenoids of Crocus sativus L: From biosynthesis to pharmacology. Springer Nature, Sinfapore 2016, ISBN 978-981-10-1898-5, doi:10.1007/978-981-10-1899-2 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Eberhard Breitmaier: Terpenes. Flavors, Fragrances, Pharmaca, Pheromones. Wiley-VCH, Weinheim 2006, ISBN 3-527-31786-4 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Michael H. Walter, Daniela S. Floß, Dieter Strack: Die facettenreiche Welt der Apocarotinoide. Farben, Düfte, Aromen und Hormone. In: Biologie in unserer Zeit. Band 39, Nr. 5, 2009, S. 336–344, doi:10.1002/biuz.200910402.
- ↑ Eintrag zu E 160b: Annatto, Bixin, Norbixin in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 30. Juni 2022.
- ↑ Andrew D. Parry, Roger Horgan: Carotenoids and abscisic acid (ABA) biosynthesis in higher plants. In: Physiologia Plantarum. Band 82, Nr. 2, 1991, S. 320–326, doi:10.1111/j.1399-3054.1991.tb00100.x.