Californium(III)-bromid
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
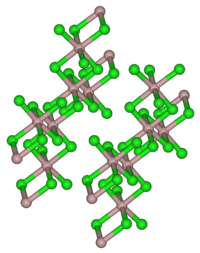
| Kristallgitter des Californium(III)-bromids (AlCl3-Typ) | |||||||
| Kristallsystem | |||||||
| Allgemeines | |||||||
| Name | Californium(III)-bromid | ||||||
| Andere Namen |
Californiumtribromid | ||||||
| Verhältnisformel | CfBr3 | ||||||
| Kurzbeschreibung |
grünliche monokline Kristalle[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 490,79 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Schmelzpunkt | |||||||
| Gefahren- und Sicherheitshinweise | |||||||
 Radioaktiv | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Californium(III)-bromid ist ein Bromid des künstlichen Elements und Actinoids Californium mit der Summenformel CfBr3. In diesem Salz tritt Californium in der Oxidationsstufe +3 auf.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Californium(III)-bromid ist ein grüner Feststoff.[3] Bei zunehmenden Temperaturen zersetzt es sich teilweise zum Californium(II)-bromid (CfBr2):
Californium(III)-bromid kristallisiert sowohl im AlCl3- als auch im FeCl3-Typ. Im ersten Fall ist das Cf-Ion sechsfach koordiniert und die drei voneinander unabhängigen Cf–Br-Bindungslängen betragen 279,5 ± 0,9 pm, 282,7 ± 1,1 pm und 282,8 ± 0,8 pm.[4]
Obwohl sich durch zunehmende Temperatur der Anteil des zweiwertigen Californiums vergrößert, konnte nur die monokline Struktur (AlCl3-Typ) für das CfBr3 nachgewiesen werden.[5]
Beim radioaktiven Zerfall des Berkeliumisotops 249Bk zu 249Cf bleiben Oxidationszahl und die jeweilige Kristallstruktur erhalten. Das sechsfach koordinierte BkBr3 (AlCl3-Typ, monokline Struktur) erzeugt ein sechsfach koordiniertes CfBr3; das achtfach koordinierte BkBr3 (PuBr3-Typ, orthorhombische Struktur) erzeugt ein achtfach koordiniertes CfBr3, eine zuvor unbekannte Form des CfBr3.[6]
Die Lösungsenthalpie von Californium(III)-bromid in 1 M Salzsäure (bei 298,15 ± 0,05 K und p0 = 101.325 kPa) wurde mit −(181,4 ± 0,9) kJ·mol−1 gemessen. Zusammen mit den Ergebnissen der Lösungsenthalpie von Californium-Metall konnte die Standardbildungsenthalpie (ΔfH0) auf −(752,5 ± 3,2) kJ·mol−1 bestimmt werden.[7]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Einstufungen nach der CLP-Verordnung liegen nicht vor, weil diese nur die chemische Gefährlichkeit umfassen und eine völlig untergeordnete Rolle gegenüber den auf der Radioaktivität beruhenden Gefahren spielen. Auch Letzteres gilt nur, wenn es sich um eine dafür relevante Stoffmenge handelt.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Californium(III)-bromid bei www.webelements.com.
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieser Stoff entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Californiumbromid (CfBr3): Der Kristall zeigt grüne Farbe.
- ↑ John H. Burns, J. R. Peterson, J. N. Stevenson: Crystallographic Studies of Some Transuranic Trihalides: 239PuCl3, 244CmBr3, 249BkBr3 and 249CfBr3, in: J. Inorg. Nucl. Chem., 1975, 37 (3), S. 743–749 (doi:10.1016/0022-1902(75)80532-X).
- ↑ J. P. Young, K. L. Vander Sluis, G. K. Werner, J. R. Peterson, M. Noé: High Temperature Spectroscopic and X-Ray Diffraction Studies of Californium Tribromide: Proof of Thermal Reduction to Californium (II), in: J. Inorg. Nucl. Chem., 1975, 37 (12), S. 2497–2501 (doi:10.1016/0022-1902(75)80878-5).
- ↑ J. P. Young, R. G. Haire, J. R. Peterson, D. D. Ensor, R. L. Fellows: Chemical Consequences of Radioactive Decay. 1. Study of 249Cf Ingrowth into Crystalline 249BkBr3: A New Crystalline Phase of CfBr3, in: Inorg. Chem., 1980, 19 (8), S. 2209–2212 (doi:10.1021/ic50210a003).
- ↑ J. Fuger, R. G. Haire, W. R. Wilmarth, J. R. Peterson: Molar Enthalpy of Formation of Californium Tribromide, in: Journal of the Less Common Metals, 1990, 158 (11), S. 99–104 (doi:10.1016/0022-5088(90)90435-M).
Literatur
[Bearbeiten | Quelltext bearbeiten]- Richard G. Haire: Californium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1499–1576 (doi:10.1007/1-4020-3598-5_11).
![{\displaystyle {\ce {2 CfBr3 ->[\Delta T] 2 CfBr2 + Br2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/062d1518dc82fcbfc0ee0fe5d9e89f34653c012d)