Räumliches Riechen

Unter dem Begriff räumliches Riechen, auch Stereoriechen genannt, versteht man die Richtungserkennung einer Duftstoffquelle durch einen Organismus. Prinzipiell ist die Lokalisierung einer Geruchsquelle auf zwei unterschiedliche Arten möglich: Auf klinotaktischem Weg, das heißt durch den Vergleich von zeitlich versetzten Informationen von einem Rezeptor/Sinnesorgan oder tropotaktisch, was einer symmetrischen Ausrichtung auf den Reiz entspricht, wozu zwei räumlich getrennte Sinnesorgane notwendig sind. In letzterem Fall spricht man von einem räumlichen Riechen. Obwohl beispielsweise alle Insekten und nahezu alle Säugetiere, einschließlich des Menschen, die physiologischen Voraussetzungen von zwei räumlich getrennten Geruchsorganen erfüllen, ist nur bei einer verschwindend kleinen Anzahl von Tierarten diese Fähigkeit bisher eindeutig experimentell nachgewiesen. Einzeller sind aus physikalischen Gründen nicht zum räumlichen „Riechen“ befähigt.

Bedeutung
[Bearbeiten | Quelltext bearbeiten]
Alle Tiere, von einzelligen Prokaryoten bis zum Menschen, orientieren sich über chemische Reize aus ihrer Umwelt. Der neuronale Vergleich bilateral, das heißt zweiseitig, empfangener Signale ist die Basis für die Fähigkeit der visuellen Raumwahrnehmung, dem räumlichen Sehen und der Lokalisierung von Geräuschen im Raum, dem räumlichen Hören bei Organismen.[2] Ermöglicht wird dies durch zwei Augen beziehungsweise zwei Ohren. Diese Konstellation ist für das Riechen bei den meisten Wirbeltieren (Vertebrata) und sehr vielen Wirbellosen (Invertebrata) ebenfalls gegeben, da fast alle dieser Organismen auch über zwei „Sensoren“, beispielsweise Nasenlöcher (Nares) oder Antennen, verfügen, die dem Geruchssinn dienen. So haben alle Unterstämme der Gliederfüßer – mit Ausnahme der Kieferklauenträger (Chelicerata) – die biologischen Voraussetzungen für ein räumliches Riechen; alle Tracheentieren (Tracheata), auch Antennata (‚Antennenträger‘) genannt, und Krebstieren (Crustacea). Mit Ausnahme der Zahnwale haben alle Säugetiere zwei Nasenlöcher. Bei Zahnwalen hat sich im Laufe der Evolution aus zwei Nasenlöchern ein ‚Nasenloch‘, das Blasloch, gebildet, während alle Bartenwale zwei ‚Nasenlöcher‘ besitzen.
Während Beitrag und Funktion von Augen und Ohren bei der räumlichen Wahrnehmung eindeutig sind, ist dies im Fall von zwei Geruchssensoren, beziehungsweise zwei getrennten Riechkanälen, die prinzipiell ein räumliches Riechen ermöglichen, bei vielen Tierarten noch völlig unklar.[2] Die Fähigkeit des räumlichen Riechens wurde bisher erst bei nur sehr wenigen Spezies, wie beispielsweise der Wüstenameise Cataglyphis fortis, dem Ostamerikanischen Maulwurf (Scalopus aquaticus) und bei Farbratten (Rattus norvegicus forma domestica) eindeutig nachgewiesen.
Prinzipien des räumlichen Riechens
[Bearbeiten | Quelltext bearbeiten]Die Information ‚Geruch‘ beziehungsweise ‚da riecht etwas‘ ist für den riechenden Organismus im Kampf ums Dasein nahezu wertlos. Ohne Lokalisation der Geruchsquelle kann er beispielsweise seine Nahrung oder seinen Sexualpartner nicht finden oder seinem Fressfeind (Prädator) nicht entkommen, wenn nicht andere Sinnesorgane diese Aufgabe adäquat erfüllen.
Die Lokalisation einer Geruchsquelle durch einen Organismus ist prinzipiell auf zwei Arten möglich. Durch serielle oder parallele Detektion des Duftstoffes. Bei der seriellen Detektion (engl. serial sampling[3] = ‚aufeinanderfolgende Probennahme‘) wird das Geruchsorgan, beispielsweise die Nase, an verschiedene Orte bewegt und der Geruchsunterschied zwischen den beiden Orten verglichen. Die Position, bei der der stärkere Geruchseindruck erhalten wurde, ist offensichtlich näher an der Geruchsquelle. Die Achse, die sich geometrisch aus den beiden Schnüffelpunkten im Raum ergibt, zeigt zumindest grob in die Richtung der Geruchsquelle. Durch weiteres serielles Riechen in Richtung dieser Achse kann die Geruchsquelle näher lokalisiert und gegebenenfalls durch andere Sinne (Sehen, Fühlen) eindeutig lokalisiert werden. Das serielle Riechen ist eine Form der Klinotaxis, das heißt der Orientierung durch den Vergleich von zeitlich versetzten Informationen von einem Rezeptor/Sinnesorgan.[4] Bei der parallelen Detektion (engl. bilateral nasal cues[3] = ‚beidseitige nasale Reize‘) erfolgt die Lokalisierung des Duftstoffes zeitgleich über zwei räumlich getrennte Riechkanäle oder Sensoren. Bei fast allen Säugetieren sind dies die beiden Nasenlöcher. Der Intensitätsunterschied, der über die getrennten Kanäle direkt festgestellt werden kann, entspricht einem Geruchsgradienten, über den wiederum die Richtung geortet werden kann. Dem seriellen Riechen entspricht beim Hören, im Fall einer einseitigen Taubheit, das Drehen des Kopfes um die Schallquelle zu orten. Das parallele Schnüffeln entspricht dann dem räumlichen Hören mit zwei Ohren, bei dem die Laufzeitdifferenz zwischen den beiden Ohren einen wesentlichen Anteil an der Richtungslokalisation der Schallquelle hat. Das parallele Riechen ist wiederum eine Form der Tropotaxis, der symmetrischen Ausrichtung auf den Reiz, zu der zwei räumlich getrennte Sinnesorgane notwendig sind.[1][4]
Die parallele Detektion hat gegenüber der seriellen einige Vorteile. Der direkte Vergleich ist zeitlich wesentlich schneller, bei Säugetieren quasi in einem Atemzug, zu bewerkstelligen. Zudem ist er – ähnlich wie bei einem Differenzverstärker in der Elektronik – deutlich sensitiver. Beim seriellen Vorgang besteht zudem die Gefahr, dass Teile der Rezeptoren beim zweiten Riechen noch durch das erste Riechen blockiert sind.
Die Fährtensuche (engl. scent-tracking), beispielsweise durch einen Fährten- oder Schweißhund, kann prinzipiell klinotaktisch, als auch tropotaktisch erfolgen. Experimentell konnte gezeigt werden, dass die tropotaktische gegenüber der klinotaktischen Fährtensuche erhebliche Zeitvorteile mit sich bringt.[5]
Einzeller und Spermien
[Bearbeiten | Quelltext bearbeiten]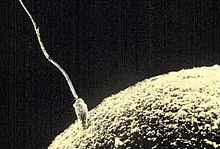
Als Chemotaxis bezeichnet man die Beeinflussung der Fortbewegungsrichtung von Organismen durch einen Stoffkonzentrationsgradienten. Bei Einzellern ist die Chemotaxis die einfachste Form einer Geruchs- bzw. Geschmacksortung und eine der grundlegendsten physiologischen Zellreaktionen. Für das Überleben von Einzellern und für eine Vielzahl von physiologischen Prozessen ist sie von großer Wichtigkeit. Sie dient beispielsweise der Lokalisierung von vorteilhaften, aber auch von schädlichen Substanzen. Vorteilhaft sind beispielsweise Nährstoffe, während Giftstoffe zu den schädlichen Substanzen zählen. Humane Spermien beispielsweise folgen dem Lockstoff Progesteron, den die Eizelle abgibt.[6] Darüber hinaus exprimieren Spermien über 30 verschiedene Riechrezeptorgene.[7] Eines davon ist das olfaktorische Gen OR1D2, das auch in der Riechschleimhaut exprimiert wird. Mutationen in OR1D2 wirken sich möglicherweise nicht nur auf die Fähigkeit der Geruchswahrnehmung des Duftstoffes Bourgeonal, sondern auch auf die Fruchtbarkeit des betroffenen Mannes aus.[8] Bourgeonal hat einen Maiglöckchen-artigen Geruch. Die Geruchsschwelle liegt bei Männern deutlich niedriger als bei Frauen. Es ist der einzige bisher bekannte Duftstoff, bei dem es einen geschlechtsspezifischen Unterschied in der Geruchsschwelle gibt.[9] Die Funktion der Riechrezeptoren der Spermien beim Befruchtungsvorgang wird kontrovers diskutiert.[10] Unabhängig davon, was die Chemotaxis bewirkt und wie der Lock- oder Schreckstoff wahrgenommen wird, auf der Ebene eines Einzellers erfolgt die Lokalisierung immer durch einen seriellen Prozess. In unmittelbarer Umgebung einer Zelle ist, bedingt durch deren geringe Größe (typischerweise im Bereich von 1 bis 10 µm) und die brownsche Bewegung, kein Konzentrationsgefälle vorhanden; die Konzentration ist isotrop. Einem ortsfesten Einzeller ist es somit nicht möglich, an zwei voneinander entfernten Stellen seiner Oberfläche mittels Rezeptoren die Richtung eines Lock- oder Schreckstoffes zu erkennen. Frei schwimmende, begeißelte Bakterien, wie beispielsweise Salmonella Typhimurium, lösen dieses Problem dadurch, dass sie zunächst eine Strecke in einer zufällig festgelegten Richtung schwimmen. Nimmt die mittels Rezeptoren detektierte Konzentration des Lockstoffes zu, so schwimmen sie weiter in diese Richtung. Nimmt sie ab, so wird die Richtung gewechselt. Bei Schreckstoffen verhalten sie sich entsprechend umgekehrt.[11][12]
Insekten
[Bearbeiten | Quelltext bearbeiten]
Bei Insekten bilden die Fühler (Antennen) die olfaktorischen Organe. Beispiele hierfür sind Bienen und Motten. Mit diesen paarigen Antennen ist über die darauf befindlichen Geruchssensillen bei einigen Insektenarten eine simultane Geruchswahrnehmung möglich. Über den Geruchs- und Zeitgradienten kann die Lokalisierung des Geruchsortes erfolgen. So kann beispielsweise der Standort einer Blüte oder der eines potenziellen Sexualpartners, der Sexuallockstoffe (Pheromone) ausschüttet, ermittelt werden. Bei dem Verlust einer Antenne bewegen sich diese Insekten im Kreis, immer in Richtung der noch verbliebenen Antenne.[13] Der Schweizer Auguste Forel (1848–1931) hatte 1910[14] als erster ein räumliches Riechen bei Ameisen postuliert.[15][16] Bei Wüstenameisen der Art Cataglyphis fortis konnte diese Fähigkeit erstmals genau 100 Jahre später nachgewiesen werden. Diese Ameisen riechen ihre Umgebung räumlich, wozu sie beide Antennen benötigen. Darüber hinaus nutzen sie die Verteilung verschiedener Düfte in der Nestumgebung, ähnlich einer Landkarte, zur Navigation. Mit zwei Experimenten wurde der Nachweis dieser Fähigkeiten bei Cataglyphis fortis erbracht. Der Nesteingang wurde mit den vier Duftstoffen Salicylsäuremethylester, Decanal, Nonanal und Indol in einem bestimmten Muster markiert und die Ameisen darauf trainiert. Wurde dieses Geruchsmuster lokal verschoben, so folgten die Tiere diesem, in der Annahme, dass dort ihr Nest sei. Wurde indes das Duftmuster verändert, verloren die Ameisen ihre Orientierung. Die aus diesen Ergebnissen abgeleitete These, dass für diese Fähigkeit, ähnlich wie beim Sehen, zwei getrennte Wahrnehumgsorgane – hier Antennen – notwendig sind, wurde im zweiten Experiment bestätigt. Ameisen mit nur einer Antenne konnten sich nicht mehr orientieren.[16][17][18]
Krebstiere
[Bearbeiten | Quelltext bearbeiten]

Die Karibik-Languste (Panulirus argus) hat am zweiten und dritten Tagma ihres Kopfes – wie alle Krebstiere – je ein Paar Antennen. Dabei werden die kleineren Antennen am zweiten Tagma Antennulae (‚erste Antennen‘) genannt. An diesen Antennulae sitzen aufgereiht die Ästhetasken (Riechschläuche, cuticularen Sensillen). Sie enthalten die olfaktorischen Sinneszellen, die der Wahrnehmung von wasserlöslichen Duftstoffen dienen.[19] Als Bewohner des Meeresbodens ist die Karibik-Languste, wie alle Zehnfußkrebse, auf die Detektion und Lokalisierung von Duftstoffen in ihrem Lebensraum angewiesen. Diese chemischen Signale steuern eine Vielzahl von Verhaltensweisen, beispielsweise Interaktionen mit Artgenossen,[20][21] das Entkommen von Fressfeinden,[22] die Versteckauswahl,[22][23][24] das Putzverhalten[25][26][27] und die Nahrungswahrnehmung und -ortung.[28][29] Beim Amerikanischen Rostkrebs (Orconectes rusticus) konnte gezeigt werden, dass er beide Antennulae zur Orientierung benötigt. Es macht keinen Unterschied, ob nur eine oder beide Antennulae entfernt wurden – die Orientierung ist in beiden Fällen gleich schlecht.[30]
Jede Ästhetaske ist bei der Karibik-Languste durch die Dendriten von etwa 300 Geruchsrezeptorneuronen innerviert,[31][32] über deren Axone die Signale zu den Glomeruli olfactorii der Riechlappen geleitet werden.[33] Lange Zeit ging man deshalb davon aus, dass die Ästhetasken die wichtigsten Sensoren für Erkennung, Unterscheidung und Ortung von Duftstoffen wären. Eine Reihe von Studien zeigt auch, dass durch eine Entfernung der Antennulae Einflüsse auf das Duftstoff-bezogene Verhalten der Karibik-Languste hat.[27] Die Languste nutzt zur Duftstofflokalisierung sowohl tropotaktische als auch klinotaktische Vergleiche von Geruchsintensitäten.[34] Neuere Studien an der Karibik-Languste konnten nachweisen, dass die Ästhetasken nicht die einzigen Sensoren auf den beiden Antennulae sind, mit denen diese Tiere ihre Nahrung lokalisieren.[35][36]
Säugetiere
[Bearbeiten | Quelltext bearbeiten]Wanderratten
[Bearbeiten | Quelltext bearbeiten]
Der Abstand der Nasenlöcher beträgt bei Wanderratten etwa 3 mm.[37] Bei einer 1999 durchgeführten Analyse der Strömungsverhältnisse der Nase konnte festgestellt werden, dass Ratten trotz dieses vergleichsweise geringen Abstands die Luft seitlich von jedem Nasenloch und dadurch getrennt einatmen. Die Überlappung der Luftströme ist beim Ein- und Ausatmen nur sehr gering. Zusammen mit dem Vorhandensein räumlicher rezeptiver Felder, die spezifisch seitlich angeordnet sind, wurde mit diesen Befunden seinerzeit die Hypothese aufgestellt, dass Ratten prinzipiell in der Lage sind, über beide Nasenlöcher unabhängige bilaterale Geruchsvergleiche vornehmen zu können.[38] Die getrennten Luftströme sind, zusammen mit den getrennten axonalen Projektionen aus der Riechschleimhaut in den Riechkolben, die Grundvoraussetzungen für diese Fähigkeit. Ausgehend von diesen Befunden untersuchte eine indische Arbeitsgruppe im Jahr 2006 die Fähigkeiten zur Geruchsortung bei Wistar-Ratten. Dabei bestimmten sie bei den Versuchstieren die Schnupperfrequenz zu 7 bis 8 Hz, das heißt, dass eine Ratte pro Sekunde sieben- bis achtmal ‚riecht‘. In den weiteren Versuchen verwendeten die Experimentatoren 2-Phenylethanol als Duftstoff, das nicht den Nervus trigeminus stimuliert.[39] Innerhalb von etwa 0,9 Sekunden, also mit einem einmaligen Schnuppern, konnten die Ratten die Richtung des 2-Phenylethanols erkennen. Bei einem vergleichenden, seriellen Schnuppern hätten die Ratten mindestens die doppelte Zeit hierfür benötigt. Die Autoren der Studie kommen abschließend zu dem Ergebnis, dass Ratten mit jedem Schnuppern eine vollständige olfaktorische Momentaufnahme ihrer Umgebung erhalten, die sowohl die Identität,[40] als auch den Ort des Geruchs beinhaltet.[37]
Ostamerikanischer Maulwurf
[Bearbeiten | Quelltext bearbeiten]

Der Ostamerikanische Maulwurf (Scalopus aquaticus) hat im Vergleich zu anderen Maulwürfen degenerierte mechanorezeptive Organe.[41] Die sehr kleinen Augen sind von Haut und Fell bedeckt und die ebenfalls sehr kleinen Ohren sind auf niedrige Frequenzen abgestimmt.[42] Für die Lokalisierung von Beute kommen diese vergleichsweise unterentwickelten Sinnesorgane kaum in Betracht. Dennoch kann sich der Ostamerikanische Maulwurf schnell und direkt in Richtung seiner Beute bewegen, wobei er während der Bewegung scheinbar seriell schnüffelt.[3] Zur Überprüfung, ob tatsächlich die Geruchsortung seriell oder doch parallel erfolgt, wurde in einer vielbeachteten Studie[43][44][45][46] im Jahr 2012 eine Versuchskammer mit mehreren definierten Nahrungsplätzen aufgebaut (siehe Skizze). Mit einem speziellen Drucksensor und einer Hochgeschwindigkeitskamera wurden Ostamerikanische Maulwürfe bei ihrer Nahrungssuche beobachtet. Dazu wurden ihnen unter anderem Nasenadapter in Form von kurzen Polyethylen-Schläuchen aufgesetzt. Mit diesem Adapter konnte der Luftstrom verändert werden. Waren die Schläuche geradlinig ausgeführt, so dass das rechte Schlauchende zum rechten Nasenloch und dementsprechend das linke zum linken Nasenloch führte, konnten die Versuchstiere unverändert schnell ihre Nahrung finden. Wurden dagegen die beiden Schläuche gekreuzt, so dass das rechte Schlauchende das linke Nasenloch mit Atemluft versorgte und das linke das rechte Nasenloch, so fanden sie ihre Nahrung nicht mehr, sondern bewegten sich meist in genau der entgegengesetzten Richtung der Nahrungsquelle. Wurde bei den Maulwürfen ein Nasenloch blockiert, so konnten sie ihre Nahrung lokalisieren, benötigten dazu aber signifikant mehr Zeit als mit zwei freien Nasenlöchern. Der Autor der Studie schließt aus seinen Ergebnissen, dass das parallele Riechen vor allem im Nahbereich von großer Wichtigkeit ist. In der Nähe der Duftquelle ist der Geruchsgradient deutlich größer als in der Ferne,[2] was bei einem Intensitätsvergleich zwischen beiden Nasenlöchern schneller und bessere Informationen über den Ort der Quelle liefert. Daraus leitet er eine hypothetische Suchstrategie ab, die aus zwei Komponenten besteht. In der Ferne, bei niedrigen Geruchsgradienten, erfolgen große Bewegungen mit seriellem Riechen an verschiedenen Orten, um die Richtung zu lokalisieren. In der Nähe der Duftquelle, also bei größerem Geruchsgradienten, sind die Bewegungen kürzer und der bilaterale Vergleich zwischen beiden Nasenlöchern steht im Vordergrund.[3] Die deutlich schlechtere Geruchsortung bei dem Verschluss eines Nasenlochs könnte indes auch einem anderen Problem geschuldet sein. Der Verschluss führt möglicherweise zu einem ständigen Zug (Bias) des Tieres in die Richtung des offenen Nasenlochs.[3]
Mensch
[Bearbeiten | Quelltext bearbeiten]

Ob der Mensch – gegebenenfalls erst durch intensives Training – in der Lage ist, räumlich zu riechen, wird kontrovers diskutiert. Grundsätzlich ging man früher davon aus, dass der Abstand der beiden Nasenlöcher bei fast allen Säugetieren, und speziell auch beim Menschen, nicht ausreicht, um räumlich getrennte Informationen zu erhalten, die für ein räumliches Riechen notwendig sind.[47] Auch spielt der Geruchssinn beim ‚Augentier‘ Mensch, beispielsweise im Vergleich zu einer Ratte, nur eine untergeordnete Rolle.[48]
Der Geruchssinn wird beim Menschen, wie bei den meisten anderen Säugetieren auch, über zwei Nerven vermittelt: Über den Riechnerv (Nervus olfactorius) und über den Nervus trigeminus. Den größten Anteil an der Geruchsempfindung hat dabei der Nervus olfactorius. Er leitet den Geruchseindruck einer Vielzahl von Duftstoffen, beispielsweise den von Vanillin oder von faulen Eiern (Schwefelwasserstoff), von der Riechschleimhaut (Regio olfactoria) zur primären Riechrinde des Großhirns (Telencephalon). Die in den Beispielen genannten Stoffe sind in geringer Konzentration reine Duftstoffe, die nur den Nervus olfactorius stimulieren. Tatsächlich stimulieren fast alle Duftstoffe darüber hinaus zusätzlich den Nervus trigeminus, der deshalb ganz wesentliche Anteile an der Wahrnehmung von Gerüchen hat.[49] Andererseits gibt es Stoffe, die in der Lage sind nur den Nervus trigeminus zu reizen. Ein Beispiel hierfür ist Kohlenstoffdioxid,[50] ein geruchsloses Gas, das in höheren Konzentrationen über den Nervus trigeminus als „säuerlich“, „prickelnd“ wahrgenommen wird.[51] Der Nervus trigeminus hat eine Schutz- oder Abwehrfunktion für eine Vielzahl von reizenden oder giftigen Stoffen.[52] Die trigeminale Stimulation führt zu Empfindungen wie „brennend“, „kühlend“ und „kribbelnd“, selbst in Abwesenheit einer olfaktorischen Wahrnehmung.[53][54]
Georg von Békésy, ungarisch-US-amerikanischer Nobelpreisträger für Physiologie oder Medizin, erkannte einige Analogien zwischen dem Hören und dem Riechen beim Menschen. 1964 veröffentlichte er die Ergebnisse eigener Studien. Dabei fand er unter anderem, dass ein Laufzeitunterschied in der Größenordnung von 0,1 Millisekunden zwischen beiden Nasenlöchern registriert wird und zur Richtungsbestimmung genutzt werden kann. Dies ist ein ähnlicher Zeitwert wie beim Hören. Daraus berechnete er einen Winkelbereich von 7 bis 10°, mit dem die Geruchsquelle prinzipiell geortet werden kann. Als Duftstoffe verwendete er unter anderem Benzol, Gewürznelken, Lavendelöl und Eukalyptusöl. Dabei stellte er bezüglich des Geruchslokalisierungsvermögens keine Unterschiede bei diesen Duftstoffen fest.[55]
Im Januar 2007 wurde eine Studie veröffentlicht,[5] bei der die 32 Studienteilnehmer unter verschiedenen Versuchsbedingungen im Freien einer 10 m langen Duftspur aus Schokoladenöl folgen mussten. Bei allen Versuchen wurden die anderen Sinnesorgane durch Brille, Gehörschutz und Handschuhe weitgehend ausgeschaltet. Zwei Drittel der Probanden waren in der Lage, der Duftspur zu folgen. Vier der dazu fähigen Teilnehmer wurden mehrere Tage zur Fährtensuche trainiert. Dabei konnte die Geschwindigkeit bei der Fährtensuche mehr als verdoppelt werden. Die Geschwindigkeit korrelierte wiederum unmittelbar mit der Schnüffelfrequenz. Bei einer Analyse der Luftströmungen im Bereich der Nase beim Schnüffeln, beziehungsweise nasalen Atmen, machten die Autoren eine überraschende Entdeckung: Jedes Nasenloch holt die Luft aus unterschiedlichen, nicht-überlappenden Bereichen im Raum. Die aus den Strömungsversuchen berechnete räumliche Auflösung beider Nasenlöcher beträgt etwa 35 mm. Geht man davon aus, dass der Grenzbereich einer Duftwolke ungefähr 10 mm breit ist,[56] so kann beim Verfolgen einer Duftspur ein Nasenloch innerhalb und eines außerhalb der Duftwolke sein. Rein physikalisch sollte ein räumliches Riechen beim Menschen also möglich sein. Um dies zu überprüfen, wurde in einer weiteren Versuchsreihe ein Nasenloch der Probanden verschlossen. Dies hatte zur Folge, dass die Fährtensuche deutlich weniger genau und signifikant langsamer als mit beiden Nasenlöchern verlief. Bekamen die Probanden einen Nasenadapter aufgesetzt, bei dem die Luft für beide Nasenlöcher zwar separat angesaugt, aber vor der Nase gemischt und dann wieder geteilt wurde, so dass die räumliche Auflösung verloren geht, waren die Ergebnisse bei der Fährtensuche ähnlich schlecht wie mit einem Nasenloch. Bei einem Nasenadapter, bei dem die beiden Luftströme nicht vor den Nasenlöchern gemischt wurden, waren die Probanden dagegen 24 % schneller. Aus diesen Ergebnissen schlossen die Autoren, dass
- Menschen prinzipiell in der Lage sind, einer Geruchsfährte zu folgen,
- diese Fähigkeit durch Training deutlich verbessert werden kann,
- die räumliche Auflösung der menschlichen Nase im Bereich von 35 mm liegt und
- die Fährtensuche durch einen internasalen Geruchsvergleich (räumliches Riechen) unterstützt wird.[5]
Andere Studien scheinen diesen Schlüssen zu widersprechen. Sie legen dar, dass zur Lokalisierung eines Geruchsstoffes eine trigeminale Stimulation notwendig ist.[50][57] 1989 konnte bei Versuchen mit reinen Duftstoffen, wie beispielsweise Schwefelwasserstoff oder Vanillin, festgestellt werden, dass bei dieser rein olfaktorischen Stimulation die Probanden nicht in der Lage waren, räumlich zu riechen. Völlig anders gestaltete sich das Versuchsergebnis, wenn Duftstoffe zu orten waren, die auch eine trigeminale Stimulation hervorrufen, das heißt die auch „schmeckbar“ sind. Hierzu gehören beispielsweise Kohlenstoffdioxid oder Menthol.[58] Dies trifft sowohl auf Kinder, als auch auf Erwachsene zu.[59] Der Mensch ist in der Lage trigeminale und olfaktorisch-trigeminale Reize zu lokalisieren, während dies bei Duftstoffen, die rein olfaktorische Reize auslösen, offensichtlich nicht oder kaum möglich ist.[58][60]
Weiterführende Literatur
[Bearbeiten | Quelltext bearbeiten]- Thomas Hummel, Antje Welge-Lüssen (Hrsg.): Taste and Smell. Band 63 von Advances in oto-rhino-laryngology. Karger Medical and Scientific Publishers, 2006, ISBN 3-8055-8123-8, eingeschränkte Vorschau in der Google-Buchsuche.
- Donald A. Wilson, Richard J. Stevenson: Learning to Smell: Olfactory Perception from Neurobiology to Behavior. JHU Press, 2006, ISBN 0-8018-8368-7, eingeschränkte Vorschau in der Google-Buchsuche.
- S. Kikuta, K. Sato u. a.: From the Cover: Neurons in the anterior olfactory nucleus pars externa detect right or left localization of odor sources. In: Proceedings of the National Academy of Sciences of the United States of America. Band 107, Nummer 27, Juli 2010, ISSN 1091-6490, S. 12363–12368, doi:10.1073/pnas.1003999107, PMID 20616091, PMC 2901466 (freier Volltext).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Video über die Auswirkungen der einseitigen Nasenlochblockierung beim Ostamerikanischen Maulwurf (Oben: linkes Nasenloch blockiert, Mitte: beide Nasenlöcher offen, Unten: rechtes Nasenloch blockiert; Material zur Publikation unter[3])
- Video über die Auswirkungen eines Nasenlochadapters beim Ostamerikanischen Maulwurf zuerst mit „normalem“ Adapter (rechtes Nasenloch wird nach rechts geführt, linkes nach links), danach mit „gekreuztem“ Adapter (rechtes Nasenloch wird nach links geführt, linkes nach rechts; Material zur Publikation unter[3])
- Veronika Szentpétery: Ratten riechen in Stereo. Bei: Telepolis vom 3. Februar 2006
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Peter M. Kappeler: Verhaltensbiologie. Springer, 2006, ISBN 3-540-24056-X, S. 113–114.
- ↑ a b c M. Louis, T. Huber u. a.: Bilateral olfactory sensory input enhances chemotaxis behavior. In: Nature Neuroscience. Band 11, Nummer 2, Februar 2008, ISSN 1097-6256, S. 187–199, doi:10.1038/nn2031, PMID 18157126.
- ↑ a b c d e f g h K. C. Catania: Stereo and serial sniffing guide navigation to an odour source in a mammal. In: Nature Communications. Band 4, 2013, ISSN 2041-1723, S. 1441, doi:10.1038/ncomms2444, PMID 23385586. (Open Access, CC BY-NC-SA 3.0)
- ↑ a b Friedrich Wilhelm Merkel, M. Walter Schäfer: Orientierung im Tierreich. Fischer, 1980, ISBN 3-437-20221-9, S. 9.
- ↑ a b c J. Porter, B. Craven u. a.: Mechanisms of scent-tracking in humans. ( vom 25. April 2013 im Internet Archive) In: Nature Neuroscience. Band 10, Nummer 1, Januar 2007, ISSN 1097-6256, S. 27–29, doi:10.1038/nn1819, PMID 17173046.
- ↑ C. Brenker, N. Goodwin u. a.: The CatSper channel: a polymodal chemosensor in human sperm. In: The EMBO Journal. Band 31, Nummer 7, April 2012, ISSN 1460-2075, S. 1654–1665, doi:10.1038/emboj.2012.30, PMID 22354039, PMC 3321208 (freier Volltext).
- ↑ Hans Hatt: Geschmack und Geruch. In: Robert F. Schmidt, Florian Lang (Hrsg.): Physiologie des Menschen. 30. Auflage. Springer, 2007, ISBN 978-3-540-32908-4, S. 421–436.
- ↑ G. Ottaviano, D. Zuccarello u. a.: Human olfactory sensitivity for bourgeonal and male infertility: a preliminary investigation. In: European archives of oto-rhino-laryngology. Band 270, Nummer 12, November 2013, ISSN 1434-4726, S. 3079–3086, doi:10.1007/s00405-013-2441-0, PMID 23525651.
- ↑ P. Olsson, M. Laska: Human male superiority in olfactory sensitivity to the sperm attractant odorant bourgeonal. In: Chemical senses. Band 35, Nummer 5, Juni 2010, ISSN 1464-3553, S. 427–432, doi:10.1093/chemse/bjq030, PMID 20378596.
- ↑ T. Strünker: Das Ende des „Maiglöckchen-Phänomens“ in der Spermienforschung? Max-Planck-Gesellschaft, vom 24. Februar 2012
- ↑ R. M. Macnab, D. E. Koshland: The gradient-sensing mechanism in bacterial chemotaxis. In: PNAS. Band 69, Nummer 9, September 1972, ISSN 0027-8424, S. 2509–2512, PMID 4560688, PMC 426976 (freier Volltext).
- ↑ J. Adler, W. W. Tso: "Decision"-making in bacteria: chemotactic response of Escherichia coli to conflicting stimuli. In: Science. Band 184, Nummer 4143, Juni 1974, ISSN 0036-8075, S. 1292–1294, PMID 4598187.
- ↑ Gilbert Waldbauer: What Good Are Bugs? Insects in the Web of Life. Harvard University Press, 2009, ISBN 978-0-674-04474-6, S. 19 eingeschränkte Vorschau in der Google-Buchsuche
- ↑ A. Forel: Das Sinnesleben der Insekten: eine Sammlung von experimentellen und kritischen Studien über Insektenpsychologie. E. Reinhardt, München, 1910.
- ↑ Karl Gößwald: Die Waldameise: Biologische Grundlagen, Ökologie und Verhalten. Aula, 1989, ISBN 3-89104-475-5, S. 404.
- ↑ a b Kathrin Steck: Smells like home: Olfactory landmarks in desert ant orientation. Dissertation, Friedrich-Schiller-Universität Jena, 2010.
- ↑ K. Steck, M. Knaden, B. S. Hansson: Do desert ants smell the scenery in stereo? In: Animal Behaviour. Nummer 4, Band 79, 2010, S. 939–945, doi:10.1016/j.anbehav.2010.01.011
- ↑ Bill S. Hansson, K. Steck, M. Knaden: Duftlandschaft in Stereo. Max-Planck-Gesellschaft, vom 9. März 2010
- ↑ Ästhetasken. In: Lexikon der Neurowissenschaft. Spektrum Akademischer Verlag, 2000
- ↑ J. Atema: Chemical signals in the marine environment: dispersal, detection, and temporal signal analysis. In: Proceedings of the National Academy of Sciences of the United States of America. Band 92, Nummer 1, Januar 1995, ISSN 0027-8424, S. 62–66, PMID 7816848, PMC 42817 (freier Volltext) (Review).
- ↑ C. Karavanich, J. Atema: Olfactory recognition of urine signals in dominance fights between male lobster, Homarus americanus. In: Behaviour. Band 135, Nummer 6, 1998, S. 719–730.
- ↑ a b D. K. Berger, M. J. Butler: Octopuses influence den selection by juvenile Caribbean spiny lobster. In: Marine and Freshwater Research. Band 52, 2001, S. 1049–1053, doi:10.1071/MF01076
- ↑ S. G. Ratchford, D. B. Eggleston: Temporal shift in the presence of a chemical cue contributes to a diel shift in sociality. In: Animal behaviour. Band 59, Nummer 4, April 2000, ISSN 0003-3472, S. 793–799, doi:10.1006/anbe.1999.1383, PMID 10792934.
- ↑ G. Nevitt, N. Pentcheff u. a.: Den selection by the spiny lobster Panulirus argus: testing attraction to conspecific odors in the field. In: Marine Ecology Progess Series. Band 203, 2000, S. 225–231, doi:10.3354/meps203225
- ↑ J. C. Barbato, P. C. Daniel: Chemosensory activation of an antennular grooming behavior in the spiny lobster, Panulirus argus, is tuned narrowly to L-glutamate. In: The Biological Bulletin. Band 193, Nummer 2, 1997, S. 107–115.
- ↑ P. C. Daniel, M. Shineman, M. Fischetti: Comparison of chemosensory activation of antennular grooming behaviour in five species of decapods. In: Marine and Freshwater Research. Band 52, 2001, S. 1333–1337, doi:10.1071/MF01013
- ↑ a b J. Wroblewska, S. Whalley u. a.: Identification of chemosensory sensilla activating antennular grooming behavior in the Caribbean spiny lobster, Panulirus argus. In: Chemical senses. Band 27, Nummer 9, November 2002, ISSN 0379-864X, S. 769–778, PMID 12438202.
- ↑ D. W. Dunham, K. A. Ciruna, H. H. Harvey: Chemosensory role of antennules in the behavioral integration of feeding by the crayfish Cambarus bartonii. In: Journal of Crustacean Biology. Band 17, 1997, S. 27–32, doi:10.1163/193724097X00052
- ↑ A. J. Horner, M. J. Weissburg, C. D. Derby: Dual antennular chemosensory pathways can mediate orientation by Caribbean spiny lobsters in naturalistic flow conditions. In: The Journal of experimental biology. Band 207, Pt 21Oktober 2004, ISSN 0022-0949, S. 3785–3796, doi:10.1242/jeb.01200, PMID 15371486.
- ↑ K. E. Kraus-Epley, P. A. Moore: Bilateral and unilateral antennal lesions alter orientation abilities of the crayfish, Orconectes rusticus. In: Chem. Senses. Band 27, Nummer 1, 2002, S. 49–55, doi:10.1093/chemse/27.1.49
- ↑ U. Grünert, B. W. Ache: Ultrastructure of the aesthetasc (olfactory) sensilla of the spiny lobster, Panulirus argus. In: Cell Tissue Research. Band 251, Nummer 1, 1988, S. 95–103, doi:10.1007/BF00215452
- ↑ C. D. Derby, H. S. Cate u. a.: Comparison of turnover in the olfactory organ of early juvenile stage and adult Caribbean spiny lobsters. In: Arthropod structure & development. Band 31, Nummer 4, April 2003, ISSN 1873-5495, S. 297–311, doi:10.1016/S1467-8039(02)00050-6, PMID 18088988.
- ↑ M. Schmidt, B. W. Ache: Antennular projections to the midbrain of the spiny lobster. II. Sensory innervation of the olfactory lobe. In: The Journal of comparative neurology. Band 318, Nummer 3, April 1992, ISSN 0021-9967, S. 291–303, doi:10.1002/cne.903180306, PMID 1583164.
- ↑ P. B. Reeder, B. W. Ache: Chemotaxis in the Florida lobster, Panulirus argus. In: Animal Behaviour. Band 28, Nummer 3, 1980, S. 831–839, doi:10.1016/S0003-3472(80)80143-6
- ↑ C. D. Derby, P. Steullet u. a.: The sensory basis of feeding behaviour in the Caribbean spiny lobster, Panulirus argus. ( des vom 15. November 2009 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: Marine Freshwater Research. Band 52, 2001, S. 1339–1350, doi:10.1071/MF01099
- ↑ P. Steullet, D. R. Kruetzfeldt u. a.: Dual antennular chemosensory pathways mediate odor-associative learning and odor discrimination in the Caribbean spiny lobster Panulirus argus. In: Journal of Experimental Biology. Band 205, 2002, S. 851–867, doi:10.1242/jeb.01200
- ↑ a b R. Rajan, J. P. Clement, U. S. Bhalla: Rats smell in stereo. In: Science. Band 311, Nummer 5761, Februar 2006, ISSN 1095-9203, S. 666–670, doi:10.1126/science.1122096, PMID 16456082.
- ↑ D. A. Wilson, R. M. Sullivan: Respiratory airflow pattern at the rat's snout and an hypothesis regarding its role in olfaction. In: Physiology & behavior. Band 66, Nummer 1, März 1999, ISSN 0031-9384, S. 41–44, PMID 10222471.
- ↑ W. L. Silver, D. G. Moulton: Chemosensitivity of rat nasal trigeminal receptors. In: Physiology & Behavior. Band 28, Nummer 5, Mai 1982, ISSN 0031-9384, S. 927–931, PMID 7100294.
- ↑ N. Uchida, Z. F. Mainen: Speed and accuracy of olfactory discrimination in the rat. In: Nature Neuroscience. Band 6, Nummer 11, November 2003, ISSN 1097-6256, S. 1224–1229, doi:10.1038/nn1142, PMID 14566341.
- ↑ K. C. Catania: Epidermal sensory organs of moles, shrew moles, and desmans: a study of the family talpidae with comments on the function and evolution of Eimer's organ. In: Brain, behavior and evolution. Band 56, Nummer 3, September 2000, ISSN 0006-8977, S. 146–174, doi:10.1159/000047201, PMID 11124516.
- ↑ K. C. Catania, J. H. Kaas: Organization of somatosensory cortex and distribution of corticospinal neurons in the eastern mole (Scalopus aquaticus). In: The Journal of Comparative Neurology. Band 378, Nummer 3, Februar 1997, ISSN 0021-9967, S. 337–353, PMID 9034895.
- ↑ jme/dpa: Räumlicher Geruchssinn: Zweites Nasenloch leitet Maulwürfe zum Futter. Bei: Spiegel Online vom 6. Februar 2013
- ↑ K. Adam: Maulwürfe orientieren sich mit zweitem Nasenloch. Bei: focus.de vom 6. Februar 2013
- ↑ Maulwürfe können stereo riechen. Bei: scincexx.de vom 6. Februar 2013
- ↑ A. Findeklee: Maulwürfe riechen stereo. Bei: Spektrum.de vom 5. Februar 2013
- ↑ D. G. Moulton: Olfaction in Mammals. In: American Zoologist. Band 7, Nummer 3, 1967, S. 421–429, doi:10.1093/icb/7.3.421
- ↑ Gerhard Aumüller, Gabriela Aust u. a.: Duale Reihe Anatomie. 2. Auflage. Georg Thieme Verlag, 2010, ISBN 978-3-13-152862-9, S. 1039. eingeschränkte Vorschau in der Google-Buchsuche
- ↑ Thomas Hummel, Jens Reden, Johannes Frasnelli: Geruchs- und Geschmackswahrnehmung. In: Joachim Funke, Peter A. Frensch (Hrsg.): Handbuch der Allgemeinen Psychologie - Kognition. Hogrefe Verlag, 2006, ISBN 3-8409-1846-4, S. 152–156. eingeschränkte Vorschau in der Google-Buchsuche
- ↑ a b A. M. Kleemann, J. Albrecht u. a.: Trigeminal perception is necessary to localize odors. In: Physiology & behavior. Band 97, Nummer 3–4, Juni 2009, ISSN 1873-507X, S. 401–405, doi:10.1016/j.physbeh.2009.03.013, PMID 19303891.
- ↑ Q. Chevy, E. Klingler: Odorless trigeminal stimulus CO2 triggers response in the olfactory cortex. In: The Journal of neuroscience. Band 34, Nummer 2, Januar 2014, ISSN 1529-2401, S. 341–342, doi:10.1523/JNEUROSCI.4466-13.2014, PMID 24403134.
- ↑ F. Viana: Chemosensory properties of the trigeminal system. In: ACS Chemical Neuroscience. Band 2, Nummer 1, Januar 2011, ISSN 1948-7193, S. 38–50, doi:10.1021/cn100102c, PMID 22778855, PMC 3369707 (freier Volltext) (Review).
- ↑ J. Frasnelli, J. Albrecht u. a.: Perception of specific trigeminal chemosensory agonists. In: Neuroscience. Band 189, August 2011, ISSN 1873-7544, S. 377–383, doi:10.1016/j.neuroscience.2011.04.065, PMID 21575683, PMC 3150232 (freier Volltext).
- ↑ M. Laska, H. Distel, R. Hudson: Trigeminal perception of odorant quality in congenitally anosmic subjects. In: Chemical Senses. Band 22, Nummer 4, August 1997, ISSN 0379-864X, S. 447–456, PMID 9279467.
- ↑ G. von Békésy: Olfactory analogue to directional hearing. In: Journal of applied physiology. Band 19, Mai 1964, ISSN 0021-8987, S. 369–373, PMID 14173530.
- ↑ J. P. Crimaldi, J. R. Koseff: High-resolution measurements of the structure of a turbulent plume. In: Experiments in Fluids. Band 31, 2001, S. 90–102.
- ↑ J. Frasnelli, G. Charbonneau u. a.: Odor localization and sniffing. In: Chemical senses. Band 34, Nummer 2, Februar 2009, ISSN 1464-3553, S. 139–144, doi:10.1093/chemse/bjn068, PMID 19001464.
- ↑ a b G. Kobal, S. Van Toller, T. Hummel: Is there directional smelling? In: Experientia. Band 45, Nummer 2, Februar 1989, ISSN 0014-4754, S. 130–132, PMID 2493388.
- ↑ T. Hummel, N. Roudnitzky u. a.: Intranasal trigeminal function in children. In: Developmental medicine and child neurology. Band 49, Nummer 11, November 2007, ISSN 0012-1622, S. 849–853, doi:10.1111/j.1469-8749.2007.00849.x, PMID 17979864.
- ↑ Therese Fark: Entwicklung eines Schmecktests für Schulkinder im Alter zwischen fünf und sieben Jahren. Dissertation. TU Dresden, 2012, S. 19–20.