Synaptischer Spalt
| Aufbau einer chemischen Synapse |
|---|
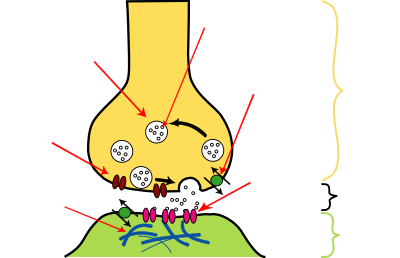
Synaptischer Spalt ist die neuroanatomische Bezeichnung für den schmalen Zwischenraum zwischen der präsynaptischen Membranregion (Präsynapse) einer Nervenzelle und der postsynaptischen (oder subsynaptischen) Membranregion (Postsynapse) einer nachgeschalteten Zelle. Für die Erregungsübertragung wird bei chemischen Synapsen der hier meist etwa 20–30 nm breite synaptische Spalt durch Ausstoß und Andocken von Botenstoffen (Neurotransmittern) überbrückt.
Funktion
[Bearbeiten | Quelltext bearbeiten]Erreicht beispielsweise ein Aktionspotential die Endigung des Axons eines Neurons, muss das Signal auf irgendeine Weise auf die Zielzelle übertragen werden; sei dies eine Nervenzelle, Muskelzelle oder Drüsenzelle. Diese Übertragung findet an den Synapsen statt. Bei elektrischen Synapsen bestehen über sogenannte gap junctions unmittelbare Verbindungen zwischen beiden Zellen, sodass Ladungsunterschiede als elektrische Signale prompt weitergegeben werden und sich eine Erregung in diesem Verbund rasch ausbreiten kann.
Bei den meisten Synapsen jedoch stehen die Plasmamembranen der prä- und postsynaptischen Regionen der verknüpften Zellen nicht in unmittelbarem Kontakt, sondern sind durch den synaptischen Spalt voneinander getrennt. Zwar ist der Interzellularraum an dieser Stelle nur ein ungefähr 20 nm schmaler Spaltraum,[1] doch die Distanz damit schon zu weit, um von elektrischen Signalen übersprungen zu werden. Im Unterschied zu elektrischen Synapsen wird hier für die Übertragung von Erregung das elektrische Signal an der präsynaptischen Endigung in ein chemisches Signal umgewandelt, nämlich in die Menge eines bestimmten Botenstoffes, Neurotransmitter genannt. Bei chemischen Synapsen hängt das übertragene Signal einerseits von Art und Menge der jeweils präsynaptisch abgegebenen Botenstoffmoleküle ab. Diese liegen in synaptischen Vesikeln verpackt an der Innenseite der präsynaptischen Membran einsatzbereit vor und werden auf das elektrische Signal (Aktionspotential) hin in den synaptischen Spalt freigesetzt durch Exozytose.
Andererseits bestimmt die postsynaptische Ausstattung mit spezifischen Membranrezeptoren für diesen Neurotransmitter, wie das chemische Signal wieder in ein elektrisches umgewandelt wird. Die präsynaptisch ausgeschütteten Moleküle diffundieren durch den Spalt und binden an die entsprechenden Neurotransmitterrezeptoren auf der postsynaptischen Membran der Zielzelle. In der Membran dieser Zelle führt dies direkt (ligandengesteuert ionotrop) oder mittelbar (metabotrop) zur Öffnung von Ionenkanälen und damit zu Änderungen des Membranpotentials. Diese können nun entweder so beschaffen sein, dass unter Umständen ein Aktionspotential dieser nachgeschalteten Zelle ausgelöst wird (exzitatorische Synapse) – oder aber so, dass eine Aktionspotentialbildung vorübergehend behindert wird (inhibitorische Synapse). Die Bindung eines Neurotransmitters an seinen Rezeptor ist meist reversibel, das heißt, er löst sich wieder und kann durch enzymatischen Abbau oder durch Wiederaufnahme in die präsynaptische Endigung aus dem Spalt entfernt werden.
Wegen der Erregegungsübertragung mittels Botenstoffen durch den synaptischen Spalt ist die Signalübermittlung bei chemischen Synapsen deutlich langsamer (synaptische Latenzzeit) als bei elektrischen. Doch erlaubt sie unterschiedliche Modulationen und verschiedene Modifikationen bei der Signalumwandlung – so beispielsweise auch Signale, die zu einer hemmenden Wirkung führen.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Bruce Alberts, u. a.: Lehrbuch der Molekularen Zellbiologie. 2. Auflage. Wiley-VCH, Weinheim 2001, ISBN 3-527-30493-2, S. 426–428.
- Neil A. Campbell, Jane B. Reece et al.: Biologie. 8., aktualisierte Auflage. Pearson Studium, 2009, ISBN 978-3-8273-7287-1, S. 1422–1424.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Donald Voet, Judith G. Voet: Biochemistry, 4th Edition. John Wiley & Sons, 2010, ISBN 978-1-118-13993-6. S. 440.